 联系我们
联系我们
人类发展史的本质是生物能效转化演进史和人类对自然资源的利用史。农耕时代,是自然条件下的传统农业,对物质和能量的利用效率低下;工业时代,工业化模式的引入使得衣食住行开始富足乃至过剩,同时带来环境和社会问题;生命时代,将是能源无极限时代,是人工智能环境下的高效生物生产生态循环,即未来农业时代。
未来农业,是在理解万物生长规律的情况下,实现能源成本大幅度下降,进一步依靠人工智能技术、工程技术、生物技术实现的高度受控的高效生物生产及新物种开发,是以超级作物、超级生产方式集成的全新物质能量转换、全新产业模式为支撑的生产生活方式,整个过程环境友好、生态、高效。
“万物生长”是华大研究院五大核心方向之一。集聚农业新资源物种,掌控农业物种生长规律,打造全球农业创新研究的数据中心。在未来农业、生态环境和超级物种领域,取得一批重大基础性原创性成果,突破一批核心关键技术,引领全球农业走向精准、可控、高效生产的新形态,为可持续发展提供可操作、可复制、可推广且高效的新模式和强有力的科技支撑。

酿酒酵母基因组设计合成计划旨在化学全合成真核模式生物酿酒酵母基因组,在帮助人类深刻理解生命的同时,通过基因组系统性重排的实现,加速酵母进化,探索其在能源、医药、环境等领域的应用。
基因组设计合成能够按需重塑生命,突破了生命发生与进化的自然法则。2011年,美国、中国、英国、新加坡、澳大利亚等国启动“酵母基因组合成国际计划”,深圳华大生命科学研究院作为中国的三个主要参与单位之一,深度参与了该国际协作项目。2017年合作联盟在Science以封面及专刊形式发表了酵母5条染色体从头合成的研究成果,证实酵母染色体基因组可从头化学全合成,并促进了多项染色体水平构建、纠错等技术的快速发展。2018年,合作联盟在Nature communications以专刊形式发表7篇文章,证明SCRaMbLE 系统可加速合成酵母基因组重排,赋予合成酵母快速定向进化的能力,助力酵母菌株工业应用。在此基础上,华大与中国的主要代表单位基于相关的研究基础,进一步探索基因组深度设计的新原则和基因组简化规律,发展基于合成型酵母的真核密码子拓展技术,以期实现基于非天然氨基酸的蛋白质功能创新,推动生命活动控制、新型抗体和疫苗研发、生物防控、新材料等多个应用领域的发展。
代表性成果:
Shen Y, Wang Y, Chen T, et al. Deep functional analysis of synII, a 770-kilobase synthetic yeast chromosome. Science, 2017, 355(6329).
Zhang W, Zhao G, Luo Z, et al. Engineering the ribosomal DNA in a megabase synthetic chromosome. Science, 2017, 355(6329): 1-7.
Mercy G, Mozziconacci J, Scolari V F, et al. 3D organization of synthetic and scrambled chromosomes. Science, 2017, 355(6329).
Mitchell L A, Wang A, Stracquadanio G, et al. Synthesis, debugging, and effects of synthetic chromosome consolidation: synVI and beyond. Science, 2017, 355(6329).
Richardson S M, Mitchell L A, Stracquadanio G, et al. Design of a synthetic yeast genome. Science, 2017, 355(6329): 1040-1044.
Wu Y, Li B, Zhao M, et al. Bug mapping and fitness testing of chemically synthesized chromosome X. Science, 2017, 355(6329): 1-6.
Xie Z X, Li B, Mitchell L A, et al. “Perfect” designer chromosome V and behavior of a ring derivative. Science, 2017, 355(6329).
Luo Z, Wang L, Wang Y, et al. Identifying and characterizing SCRaMbLEd synthetic yeast using ReSCuES.[J]. Nature Communications, 2018, 9(1).
Liu, W., Luo, Z., Wang, Y., et al. (2018). Rapid pathway prototyping and engineering using in vitro and in vivo synthetic genome SCRaMbLE-in methods. Nature communications, 9(1), 1936.
Jia B, Wu Y, Li B, et al. Precise control of SCRaMbLE in synthetic haploid and diploid yeast. Nature Communications, 2018, 9(1): 1933.
Blount B A, Gowers G F, Ho J C, et al. Rapid host strain improvement by in vivo rearrangement of a synthetic yeast chromosome. Nature Communications, 2018, 9(1): 1932.
Shen M J, Wu Y, Yang K, et al. Heterozygous diploid and interspecies SCRaMbLEing. Nature Communications, 2018, 9(1): 1934.
Wu Y, Zhu R Y, Mitchell L A, et al. In vitro DNA SCRaMbLE. Nature Communications, 2018, 9(1).
Hochrein L, Mitchell L A, Schulz K, et al. L-SCRaMbLE as a tool for light-controlled Cre-mediated recombination in yeast. Nature Communications, 2018, 9(1).
Shen Y, Stracquadanio G, Wang Y, et al. SCRaMbLE generates designed combinatorial stochastic diversity in synthetic chromosomes. Genome Research, 2016, 26(1): 36-49.

蛋白质既是生命的物质基础,也是生命活动的主要承担者。蛋白质功能创新被认为是推动生物技术和生物医药等领域发展的重要引擎之一,因此一直是科学研究的重点。本项目从“工具”和“底盘”两个维度来构建高效的真核基因密码子拓展技术,通过挖掘和改造蛋白质翻译工具,并构建高适配的真核底盘细胞,实现在真核生物(酿酒酵母为代表)中高效地基因编码非天然氨基酸。通过拓展天然编码系统有限的蛋白质构筑基元种类(20种天然氨基酸),探索非天然氨基酸在多肽、酶、抗体结构和功能创新中的关键作用,从而推动生命活动控制、新药研发、生物制造等多个应用领域的发展。
该项目受到国家及省市级多个项目的支持,包括国家重点研发计划1项、国家自然科学基金项目2项、广东省面上项目1项、深圳科创委项目1项,累计获批1559万。
代表性文章:
Haolin Zhang&, Xuemei Gong&, Qianqian Zhao&, Takahito Mukai, Oscar Vargas-Rodriguez, Huiming Zhang, Yuxing Zhang, Paul Wassel, Kazuaki Amikura, Julie Maupin-Furlow, Yan Ren, Xun Xu, Yuri I Wolf, Kira S Makarova, Eugene V Koonin, Yue Shen*, Dieter Söll*, Xian Fu*. The tRNA discriminator base defines the mutual orthogonality of two distinct pyrrolysyl-tRNA synthetase/tRNAPyl pairs in the same organism. 2022. Nucleic Acids Res. 50(8):4601-4615. (& 同等贡献; *通讯作者).
付宪,林涛,张帆,张惠铭,章文蔚,杨焕明,朱师达,徐讯,沈玥. 基因密码子拓展技术的方法原理和前沿应用研究进展[J]. 合成生物学,2020,1(1):103-119
Fu Xian,Lin Tao,Zhang Fan,Zhang Huiming,Zhang Wenwei,Yang Huanming,Zhu Shida,Xu Xun,Shen Yue. Progress in the study of genetic code expansion related methods, principles and applications[J]
. 2020. Synthetic Biology Journal. 1(1): 103-119
《合成生物学》是我国目前唯一专注于合成生物学领域的中文科技期刊,该综述受邀发表在《合成生物学》创刊号

Yanrui Ye*, Minmin Zhong , Zhanhua Zhang, Tai Chen, Yue Shen, Zhanglin Lin*, and Yun Wang* . Genomic Iterative Replacements of Large Synthetic DNA Fragments in Corynebacterium glutamicum.
ACS Synth. Biol. 2022, 11(4) 1588–1599

血液疾病治疗平台以中国南方高发的地中海贫血(地贫)为切入点,已建立造血干细胞基因治疗(HSC-GT)整套的技术流程,筛选获得治疗beta地贫的高效慢病毒载体,完成临床级慢病毒载体的工艺研发和制备,并在患者样品中验证载体有效性和安全性的技术指标可对标国外上市产品(Zynteglo)。同时,研究院已建成符合GMP要求的“C+隔离器”厂房和相应的管理体系,可满足细胞治疗产品的制备要求。在上述基础上,在符合伦理和相关法规要求前提下,研究院正在与合作医院推进beta地中海贫血基因治疗的临床试验,有望为全国五万重型地贫患者提供治愈方案,节省数千亿医疗支出。同时,针对多种血液相关的其他疾病(如alpha地贫,异染性脑蛋白营养不良症和先天重型免疫缺陷征等),在已建成的平台基础上,进行技术研发,可加速相关治疗手段的转化应用,有力推进中国基因治疗领域的发展。
代表性文章:
Ouyang, WJ., Dong, GY., Zhao, WH., et al. Restoration of β-globin expression with optimally designed lentiviral vector for β-thalassemia treatment in Chinese patients. Human Gene Therapy.2020 Dec.

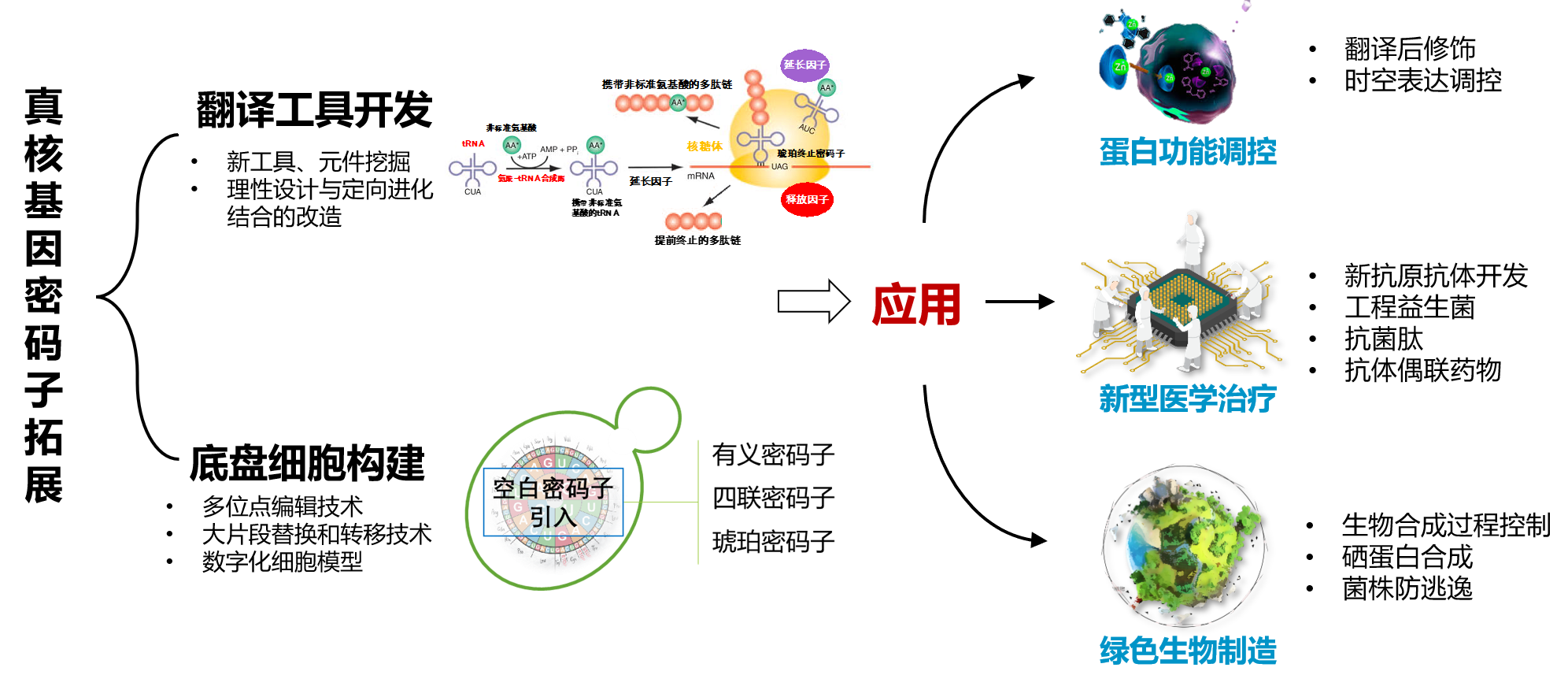
癌症免疫治疗平台,初始围绕neoT产品,从多肽质谱数据库建立、新抗原AI预测模型到T细胞产品流程中DC疫苗、长短肽工艺、四聚体合成技术等流程进行优化,实现了召回率80%情况下新抗原预测准确率40%,核心原料成本降低50%T细胞治疗产品工艺;而后进一步从临床肿瘤样本出发,实现了肿瘤临床样本新抗原的直接质谱鉴定及其特异性T细胞单细胞多组学多维度特征性分析及功能验证,开发了非病毒基因转移技术、高通量可视化TCR筛选技术、基于CRIPSR基因编辑技术的下一代T细胞改造技术,形成了肿瘤免疫治疗的一贯式研发平台,并结合华大测序及大数据平台优势,着力搭建了肿瘤新抗原及其特异性功能性TCR数据库,为临床肿瘤患者个性化精准免疫治疗提供了候选多肽靶点及TCR-T细胞产品。
代表性文章
Zhu L, et al. Single-Cell Sequencing of Peripheral Mononuclear Cells Reveals Distinct Immune Response Landscapes of COVID-19 and Influenza Patients. Immunity. 2020 Sep 15;53(3):685-696.e3.
Gao Q, et al. Selective targeting of the oncogenic KRAS G12S mutant allele by CRISPR/Cas9 induces efficient tumor regression. Theranostics. 2020 Apr 6;10(11):5137-5153.
Wang F, et al. A single-cell approach to engineer CD8+ T cells targeting cytomegalovirus. Cell Mol Immunol. 2020 May 25:1–3.
已授权专利
药物组合物及其方法和制备. 专利号PCT/CN2020/118108
肿瘤突变抗原UNC93A的中国人群高频HLA-A*11:01分型限制性T细胞表位和TCR序列及其应用,申请号202011482249.2;
靶向巨细胞病毒抗原的特异性T细胞受体,申请号202010040290.8;
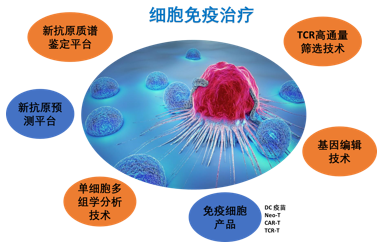
相对于传统抗体,“纳米抗体”具有分子量小、毒性低、组织渗透性强、溶解性好、易改造与表达的特点,它们能克服传统抗体的不足,并大大降低抗体药物的生产成本。纳米抗体项目组结合二代高通量测序技术和质谱技术已建立高通量抗体筛选制备平台以及噬菌体展示技术。结合生物信息分析,可针对包括免疫检查点的不同靶点,直接从海量的抗体库中获得具有超高亲和力和靶点特异性的优秀单抗候选克隆。基于构建的双特异性抗体平台,将两个不同靶点的抗体经偶联形成双价靶向抗体,实现了单克隆抗体联合用药无法实现的协同效应,使得双特异性抗体成为生物医学、药理学和诊断学进一步研究的重要对象。团队研发的新型抗体PCSK9抑制剂B11-Fc在大鼠模型上可以达到与上市药物Repatha同样的降血脂效果,生产和储存成本可以显著降低20倍以上;研发的新型双特异抗体P4C4与上市药物亲和力一致(KD值可达1E-09M)。初步打通了从筛选到验证的药物开发产业技术环节,为创新型一类药物的产业化开发做好了技术准备。
代表性文章
Li, XY., Wang, MN., Zhang, XH., et al. The novel llama-human chimeric antibody has potent effect in lowering LDL-c levels in hPCSK9 transgenic rats. Clinical and Translational Medicine.2020 Feb.
传统植物改良技术匮乏、周期长、成本高,已无法满足现阶段和未来植物新品种需求。
植物基因组编写平台,旨在整合传统细胞工程技术和基因组定向编辑技术,开发植物人工染色体设计与合成等新型细胞工程技术,构建新型高通量植物定制化育种研究平台,促进观赏植物、作物等植物新品种的培育和应用研究。平台基于华大构建的植物多组学数据库,分析挖掘控制相关性状的功能元件,组建功能元件库;针对性建立高效的植物基因组编辑技术、遗传转化技术,定向编写靶标元件,实现对目标植物的定向化工程改造和价值提升;开发超微量和高通量植物测序鉴定技术,实现工程化改造植物的快速高通量鉴定,大幅缩短新品种培育周期;开发植物人工染色体设计与合成技术,实现高通量筛选和高效组装优势功能元件,提供和满足未来个性化、定制化植物新品种需求。
代表性成果,申请发明专利:
一种适用于微量样本的DNA样本制备方法,顾颖,刘光宇,夏科科,杨勇,2021.01.04,中国,202011642164.6
一种谷子原生质体的制备及转化方法,刘光宇,崔震,顾颖,侯勇,2019.07.31,中国,201910699529.X
一种兰科植物原生质体的制备及转化方法和应用,夏科科,章登位,郝璋颖,顾颖,沈玥,2018.11.19,中国,201811368571.5

以深圳华大生命科学研究院全球领先的基因组学和生物信息学技术为支撑,结合国家基因库建设的平台优势,开展重要农业农作物全球资源基因组测序和核心种质的大型重测序研究,构建基因组及表型信息数据库,对重要性状相关基因进行全面的挖掘和保护;以丰富的基因组数据为指导,完善重要作物的分子标记系统,开发具有自主知识产权的全基因组分子育种技术,推动及引领我国乃至全球作物育种研究的持续发展。
项目组积极拓展国内外全球化合作,已经完成3100份水稻(Nature 2018),2000份谷子,400份( Nature Genetics 2019 )及3000份鹰嘴豆等代表性物种。正在开展1.2万份鹰嘴豆,3000份生菜,3000份花生,5000份玉米,2000份向日葵等重要作物群体遗传学研究。
自2011年成立以来,实验室累计承担及参与各级政府项目共计40多项,主要有863计划1项、国家科技支撑计划3项、国家重点研发计划3项、国家自然科学基金项目3项、深圳市区级知识创新计划28项。
近5年代表性成果:
1.Wei T. et al., Whole-genome resequencing of 445 Lactuca accessions reveals the domestication history of cultivated lettuce. Nature Genetics 2021, 53(5):1-9
2.Varshney R, et al. Resequencing of 429 chickpea accessions from 45 countries provides insights into genome diversity, domestication and agronomic traits. Nature Genetics (2019) 51:857
3.Rajeev KV, et al., Pearl millet genome sequence provides a resource to improve agronomic traits in arid environments,Nature Biotechnolgy (2018)36, 368
4.Wang W, et al. Genomic variation in 3,010 diverse accessions of Asian cultivated rice. Nature (2018) , Fan W, Tian G, Zhu H, et al.The sequence and de novo assembly of the giant panda genome. Nature (2018) 557:43
